Efterhånden som man vandt kendskab til flere og flere grundstoffer, kunne de samles i grupper med nogenlunde ens kemiske egenskaber og i hver gruppe efter voksende masse. Således var der de stærkt elektropositive alkalimetaller lithium, kalium, natrium mfl. Denne gruppering i et periodisk system gennemførtes af Dmitrij Mendelejev fra og med 1869. Han fandt i det væsentlige syv grupper med forskellige kemiske egenskaber, periodisk gentaget for (omtrent) voksende atomvægt. Adskillige andre forskere opstillede lignende systemer, men Mendelejev kunne med held, ud fra huller i rækken, give præcise forudsigelser om egenskaberne af nye grundstoffer. På det tidspunkt vidste man ikke, at der eksisterede en ottende gruppe, de ædle luftarter. Langt senere, i 1894-98, fandt man netop luftarterne helium, neon, argon, krypton og xenon, der ikke dannede kemiske forbindelser.
Tilordningen efter atommasse var ufuldkommen, og med Bohr-Rutherford-atomet i 1913 var der ingen tvivl om, at atomnummeret Z bestemtes af atomkernens ladning Z∙e, Z = 1, 2, 3,.... Straks i 1913 kunne den unge eksperimentalfysiker Henry Moseley bidrage med at fastlægge mange atomnumre på basis af den røntgenstråling, der udsendtes, når atomet manglede en af de inderste elektroner. Samtidig kom man til erkendelse af, at for et givet atomnummer Z eksisterede der som regel flere forskellige atommasser. De betegnes som isotoper (gr. isos topos, 'samme sted'). Man indførte også et massetal A for atomkernen. I dag ved vi, at massetallet A = Z+N er summen af antallet af protoner, Z og antallet af neutroner, N. Neutronen har en masse, der kun er lidt større end protonens masse. Atomkernens masse er næsten proportional med A; afvigelserne skyldes især de meget store bindingsenergier i atomkernerne.
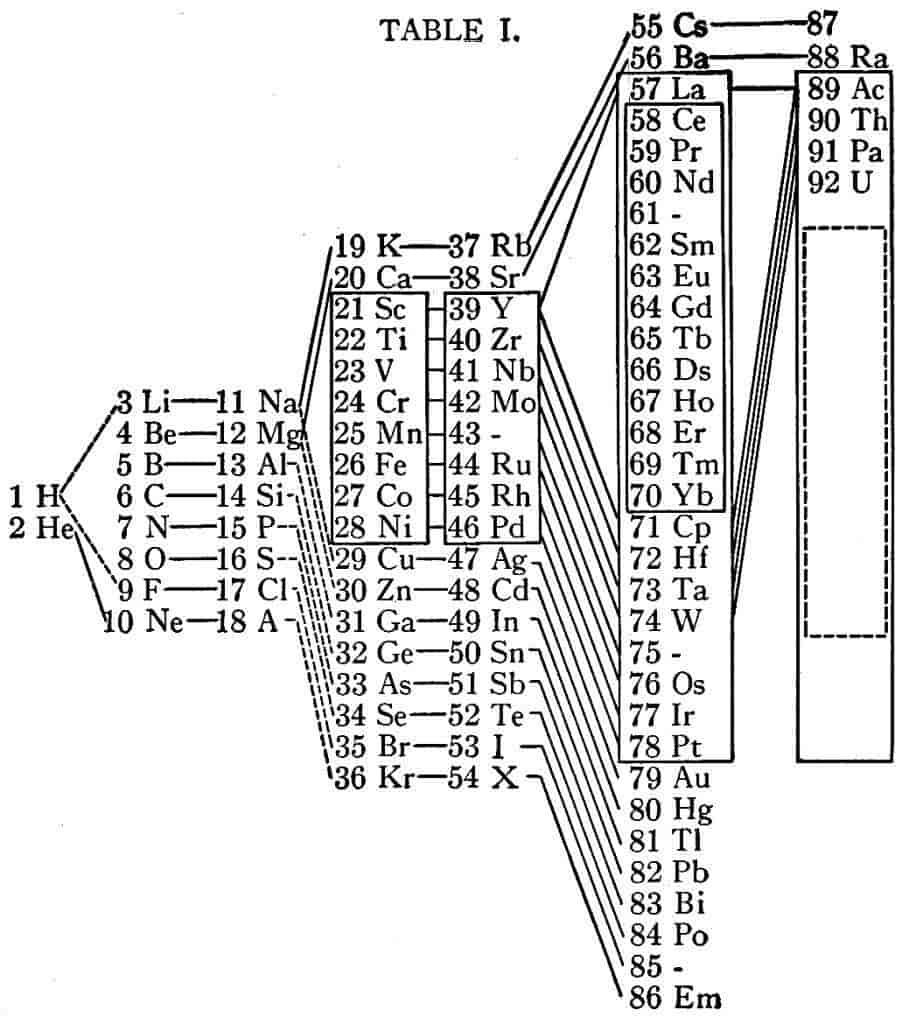
På trods af at Bohr i virkeligheden manglede et kvantetal foruden et afgørende princip, var han alligevel i stand til i den følgende tid (især 1920-23) efterhånden at gruppere elektronerne korrekt i skalstrukturer. Ud over kvantetallene benyttede han frem for alt korrespondensprincippet til analyse af den stråling, der udsendtes. Desuden byggede han gradvis op; hvis man fx starter fra brintatomet, sidder elektronen i laveste tilstand, med n = 1, l = 0. I helium, med Z = 2, kunne man fra stråling og energibetragtning indse, at også den anden elektron havde n = 1, l = 0. For lithium, Z = 3, skulle de to første elektroner være som i helium, men analyse af eksperimenter viste, at den tredje elektron måtte have n = 2 og antagelig l = 0, altså en svag binding, som det gælder for alkalimetaller. Det lykkedes Bohr at slutte, at i en fyldt skal med hovedkvantetal n er der plads til 2n2 elektroner, og det er fuldt korrekt. På denne basis kunne han fx forudsige egenskaberne i grundstof nr. 72, hafnium. Bohrs fremstilling af det periodiske system er gengivet på figuren, hvor grundstoffer med analoge egenskaber er forbundet med skråstreger.
Ved årsskiftet 1924-25 skete et afgørende fremskridt, idet udelukkelsesprincippet (Pauliprincippet) blev indført af Wolfgang Pauli. Han påstod først, at for hver kvantetilstand i en elektrons banebevægelse, dvs. faste værdier af n, l og m, var der to kvantetilstande for elektronen. Dernæst postulerede han, at i hver kvantetilstand for elektronen kunne der kun være 0 eller 1 elektron, ikke flere. Det var således ikke kræfterne mellem elektronerne, der tvang dem til opbygning i successive skaller, men derimod et udelukkelsesprincip. Paulis nye kvantetal blev i 1925 forklaret af S.A. Goudsmit og E. Uhlenbeck, som et indre impulsmoment af elektronen, det såkaldte spin, hvor det tilhørende kvantetal, s, kun kunne antage værdierne 1/2 og -1/2. Dette betød, at en elektrons totale impulsmoment omkring atomkernen ikke var l, men i stedet l+1/2 eller l-1/2. Herved kunne man forklare atomspektrene og deres udvalgsregler (dvs. hvilke overgange i atomet, der var mulige). Skemaet illustrerer, hvorledes opfyldningen af på hinanden følgende skaller fører til den karakteristiske periodicitet. Således kunne Bohrs kvanteteori sammen med spin og udelukkelsesprincip give en acceptabel fysisk beskrivelse af grundstofferne; alligevel var denne kvanteteori ikke helt korrekt.





Kommentarer (2)
skrev Hans Ørbæk
Jeg synes det er lidt skævt at gøre Empedokles til eksponent for den klassiske atomteori. Epikur ville være et bedre bud ved siden af Demokrit. Jf. artiklerne om de forskellige i leksikonet.
svarede Suzanne Rindom
Kære Hans Ørbæk
Tak for dit ændringsforslag.
Redaktionen har ikke tilstrækkelig faglig indsigt til at kunne vurdere dit ændringsforslag. Når vi får knyttet en fagansvarlig med den rette baggrund til fagområdet, vil vi lade vedkommende tage stilling til dit forslag.
Med venlig hilsen
Suzanne Rindom
Kommentarer til artiklen bliver synlige for alle. Undlad at skrive følsomme oplysninger, for eksempel sundhedsoplysninger. Fagansvarlig eller redaktør svarer, når de kan.
Du skal være logget ind for at kommentere.