De biologiske skadevirkninger af stråling fra radioaktive isotoper beror på strålingens evne til at ionisere og excitere atomer og molekyler i levende organismer. Ved høje doser kan strålingen ødelægge vitale væv og livsprocesser, så organismerne får strålesyge eller dør. Selv ved lave doser kan der være risiko for alvorlige skader, hvis strålingen forårsager ændringer i DNA-molekylerne, som bærer den genetiske kode og styrer cellernes livsprocesser. Disse ændringer kan være årsag til kræftsygdomme, fx leukæmi eller udvikling af kræftsvulster. Sker ændringerne i kønscellernes DNA (mutation), kan det muterede arvemateriale nedarves fra generation til generation og komme til udtryk som fx misdannelser eller nedsat levedygtighed.
radioaktivitet (biologi og forurening)
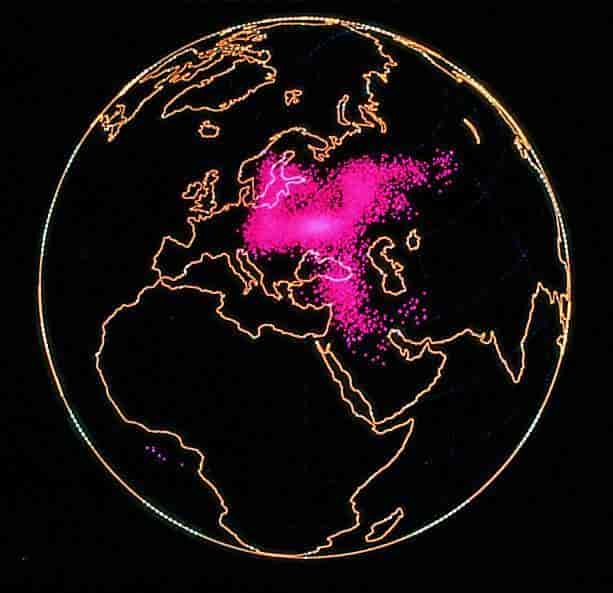
Efter ulykken på Tjernobyl-kernekraftværket i 1986 spredtes radioaktive stoffer med vinden til mange lande (udbredelsen fire dage efter ulykken er vist med rødt). Stofferne følger med nedbøren til jordoverfladen, hvor de optages i fødekæderne og akkumuleres i planter, dyr og mennesker. Pga. vindretningen blev bl.a. Sverige og Norge ramt, hvilket fik konsekvenser for produktionen af rensdyrkød. Det lav, som rensdyrene lever af, havde ophobet radioaktive stoffer.

Det officielle advarselssymbol for strålingsfare i forbindelse med radioaktivitet.
Virkninger i biologiske væv
Når ioniserende stråling trænger ind i organismers væv, afsætter den sin energi i en serie af sammenstød og vekselvirkninger med atomer og molekyler. Således dannes elektrisk ladede partikler (ioner) og frie radikaler, der reagerer med DNA og andre organiske molekyler, således at de kemiske egenskaber forandres.
De forskellige typer af ioniserende stråling afsætter deres energi på hver sin måde. Alfapartikler kan i luft kun vandre nogle få cm fra strålingskilden. De bremses i et tykt stykke papir og kan kun trænge op til 0,05 mm ind i biologiske væv. Selv et tyndt hudlag kan beskytte de underliggende levende celler mod strålingen. Betapartikler kan derimod vandre flere m i luft. De mest energirige kan trænge igennem en næsten 3 mm tyk blyplade og flere mm ind i biologiske væv. Gammastråling er meget energirig og kan vandre op til flere hundrede m i luft, gå igennem centimetertykke blyplader og trænge langt ind i biologisk væv. Gammastråling kan således skade væv, også når strålingskilden er langt fra organismen, mens alfa- og betastråling er særlig farlige, hvis strålingskilden kommer ind i organismen, fx med luften eller føden. Risikoen er endnu større, hvis radioaktive isotoper opsamles i særlige væv, fx jod-131 (131I) i skjoldbruskkirtlen.
Den ioniserende strålings biologiske virkning afhænger ikke alene af strålingens aktivitet, men også af dens energi og type. Foruden et mål for den energi, strålingen afsætter i levende væv, har man indført et mål for strålingens potentielle skadevirkning. Den energi, der absorberes i det biologiske materiale, kaldes strålingsdosis (se dosis); den absorberede dosis måles i gray (Gy). 1 Gy svarer til overførsel af 1 Joule til 1 kg væv. Tidligere anvendtes enheden rad (radiation absorbed dose); 1 rad svarer til 0,01 Gy. Alfapartikler kan imidlertid anrette større skade i vævene end den samme strålingsdosis af fx gammastråling. Alfapartiklerne afsætter deres energi inden for et snævert område, i kort afstand fra strålingskilden. Beta- og gammastråling vandrer derimod over længere afstande, så energien fordeles over større områder af vævet. Ved sammenligning af skadevirkningen af forskellige strålingstyper omregnes den absorberede strålingsdosis til den virkning, som den samme strålingsdosis af gammastråler udøver. Denne ækvivalente strålingsdosis eller ækvivalentdosis angives i sievert (Sv). For gamma- og betastråling svarer 1 Gy til 1 Sv, mens den ækvivalente dosis af alfastråling er 20 gange større end den absorberede. Tidligere anvendte man enheden rem; 1 rem svarer til 0,01 Sv. Se også strålingsbiologi.
Virkninger af radioaktiv forurening i økosystemer
Den menneskeskabte forurening af omgivelserne med radioaktive isotoper hidrører især fra kernevåbensprængninger, udslip fra kernekraftværker, dumpning og udledning af radioaktivt affald fra fx oparbejdningsanlæg samt anvendelse i medicinen. Desuden frigives naturlige radioaktive isotoper som fx polonium-210 (210Po) til omgivelserne ved industrielle aktiviteter, fx fremstilling af gødning ud fra råfosfat samt udvinding og afbrænding af gas og olie. Radioøkologien omhandler radioaktive isotopers spredning, omsætning og virkning i økosystemerne. En stor del af de radioaktive isotoper, der slipper ud i atmosfæren, vaskes med nedbøren ned på jord og vand. Her kan isotoperne optages af de levende organismer og således komme ind i de økologiske kredsløb.
Ved ulykken på Tjernobylværket i Ukraine i 1986 slap store mængder jod-131 ud i omgivelserne, hvor det især blev afsat i vegetationen. Græssende kvæg spiste det inficerede græs og bragte radioaktivt jod videre til de mennesker, der spiste kødet eller drak mælken. Jod-131 kan være særlig skadeligt for kvæg og mennesker, fordi det radioaktive jod kan ophobes i skjoldbruskkirtlen på samme måde som ikke-radioaktivt jod. Efter Tjernobyl-ulykken døde det meste kvæg inden for en radius af 30 km, og de få overlevende dyr havde nedsat vækst og forstørret skjoldbruskkirtel. Som det er almindeligt ved ulykker, hvor radioaktivt jod slipper ud i omgivelserne, fik befolkningen et tilskud af inaktivt jod i form af jodtabletter. Inaktivt jod kan mætte skjoldbruskkirtlen, så radioaktivt jod ikke ophobes, men hurtigt udskilles af kroppen.
Radioaktiv ophobning i fødekæder
Halveringstiden for jod-131 er ca. otte døgn, og risikoen for strålingsskader tager derfor hurtigt af. Farligere er strontium-90 (90Sr) og cæsium-137 (137Cs) med halveringstider på hhv. 28 og 30 år. Disse isotoper dannes bl.a. ved uheld på kernekraftværker og sprængninger af kernevåben. Hverken strontium eller cæsium indgår i det normale stofskifte, men isotoperne er kemisk beslægtede med andre stoffer, som levende organismer ikke kan undvære. Strontium-90, der udsender betastråling, kan forveksles med calcium og blive opsamlet i knoglerne. Her kan strålingen forårsage leukæmi i den bloddannende knoglemarv eller knoglekræft i knoglevævet. Cæsium-137, der udsender beta- og gammastråling, kan forveksles med kalium, som findes i alle levende celler og spiller en afgørende rolle i reguleringen af cellernes ionbalance.
I et dansk landbrugsøkosystem har man fulgt indholdet af strontium og cæsium gennem fødekæden fra korn over kød og mælk til mennesket. Fra led til led blev der forholdsmæssigt mindre strontium end calcium, men mere cæsium end kalium. Ophobningen af radioaktive isotoper i fødekæderne spiller en særlig rolle i fx arktiske områder. Her består vegetationen flere steder især af laver. De vokser kun langsomt, kan blive meget gamle og opsamler på deres overflade radioaktive isotoper fra bl.a. nedfald. Om vinteren er laverne stort set den eneste fødekilde for rensdyr, hvis kød og mælk kan være befolkningens væsentligste kost. I visse inuitsamfund i Canada spiser hver person 1 kg rensdyrkød om dagen og udsættes således for særlig høje strålingsdoser.
Ændringer i økosystemer
Pattedyr er generelt mere følsomme over for ioniserende stråling end andre dyr, og planter mere følsomme end bakterier, men følsomheden varierer stærkt fra art til art. Således kan strålingen forårsage ændringer i økosystemernes artssammensætning og stofkredsløb.
På Long Island ved New York bestrålede man i en årrække en skov med ege- og fyrretræer fra en kunstig cæsium-137-kilde. Ved de højeste strålingsdoser overlevede kun nogle få laver og mosser. I større afstand fra strålingskilden dannede en enkelt art af star et sammenhængende plantedække, mens der i zonen udenfor kun kunne vokse lave buske af bl.a. blåbær. Høje træer var mest følsomme over for strålingen, fyrretræer mere end egetræer.
Biologisk og økologisk halveringstid
I økosystemerne afhænger virkningen af strålingen bl.a. af, hvor længe de radioaktive isotoper opholder sig i fødekædernes enkelte led. Den biologiske halveringstid for cæsium-137 i en organisme er meget kortere end den fysiske. Den varierer stærkt fra art til art og afhænger desuden af bl.a. alder og ernæringstilstand. For visse ferskvandsfisk er den biologiske halveringstid kun omkring ét døgn, mens den er ca. 100 gange længere for mennesker.
Den økologiske halveringstid er tiden, fra en mængde af en radioaktiv isotop kommer ind i fødekæden, til der kun er halvt så meget tilbage. Her spiller bl.a. klima, vandets ionindhold og jordbundstypen en afgørende rolle. Mange radioaktive isotoper tilbageholdes i højere grad i lerjorder end i sandjorder. For cæsium-137 er den økologiske halveringstid længere end den biologiske, ofte 3-4 år, og i nordnorske fjeldegne, hvor vegetationen især består af laver, har man målt halveringstider på ca. seks år i landjordens fødekæder.
Mindre forurening med radioaktive stoffer
Eftervirkningerne af de omfattende kernevåbenforsøg i 1950'erne og 1960'erne er gradvis aftaget, efterhånden som de radioaktive isotoper er faldet hen eller er blevet bundet til partikler i jord- og havbunden. Gennem internationale aftaler som Londonkonventionen og MARPOL-konventionen er udledningen af radioaktive stoffer til bl.a. havet blevet stærkt begrænset, fx fra oparbejdningsanlæggene Sellafield i England og ved Cap de la Hague i Frankrig. Endvidere er sikkerhedsforholdene på kernekraftværker blevet skærpet.




Kommentarer
Kommentarer til artiklen bliver synlige for alle. Undlad at skrive følsomme oplysninger, for eksempel sundhedsoplysninger. Fagansvarlig eller redaktør svarer, når de kan.
Du skal være logget ind for at kommentere.