Resonansteori, i kemien en metode til at beskrive visse ioner og molekylers sande kemiske struktur, baseret på kvantemekaniske beregninger.
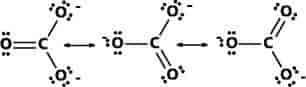
En ion eller et molekyle beskrives bedst ved at opskrive to eller flere såkaldte Lewis-strukturer og betragte den virkelige forbindelse som sammensat af disse strukturer. Eksempelvis kan der opskrives tre Lewis-strukturer for carbonat-ionen, hvor elektronerne i de enkelte strukturer placeres omkring atomkernerne som prikker svarende til antallet af elektroner i atomets ydre valensskaller. En binding mellem to atomer kan udtrykkes ved en streg (svarende til to elektroner). De tre viste Lewis-strukturer betegnes som ækvivalente, symboliseret med en dobbeltpil.
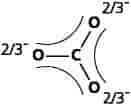
Ordet resonans — undertiden betegnet mesomeri — kunne antyde, at bindinger og elektroner konstant skifter frem og tilbage mellem de enkelte strukturer. Dette er dog ukorrekt. I det virkelige molekyle, der betegnes som en resonanshybrid af de enkelte resonansstrukturer, er den negative ladning fordelt eller delokaliseret over alle tre oxygenatomer, og alle C−O-afstande er lige store i det plane molekyle.
Resonansteorien blev hovedsagelig udviklet af L. Pauling i 1930'erne og har bl.a. afgørende betydning for forståelsen af struktur og egenskaber af aromatiske forbindelser som fx benzen.




Kommentarer
Kommentarer til artiklen bliver synlige for alle. Undlad at skrive følsomme oplysninger, for eksempel sundhedsoplysninger. Fagansvarlig eller redaktør svarer, når de kan.
Du skal være logget ind for at kommentere.