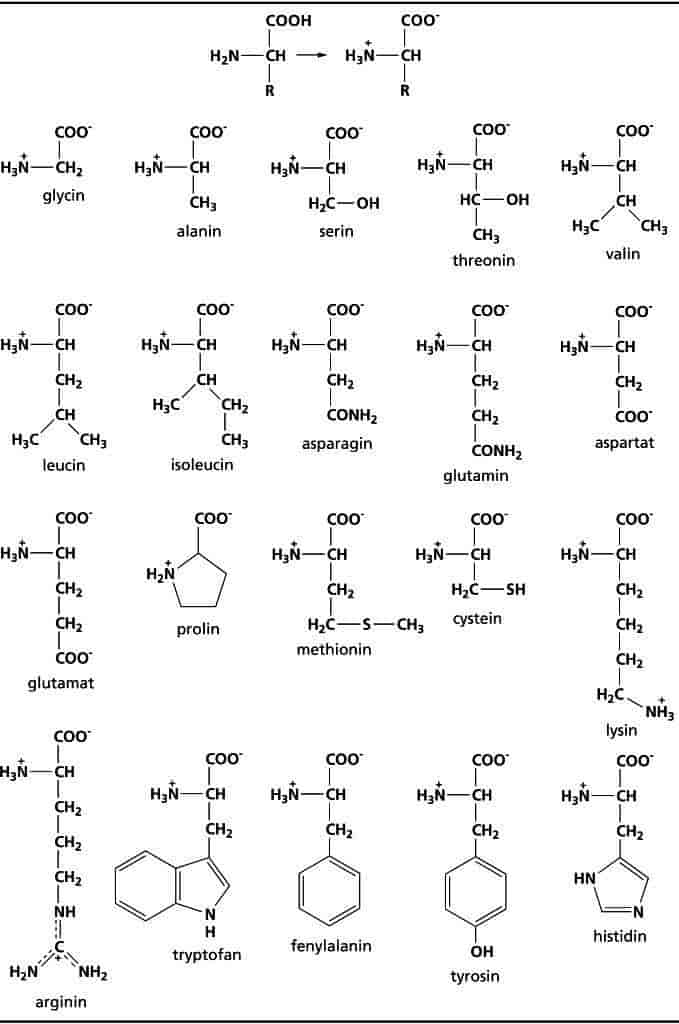
Man skelner mellem proteiners primære, sekundære, tertiære og kvaternære struktur. Aminosyrernes rækkefølge i polypeptidkæden og den kemiske struktur af de enkelte aminosyrer bestemmer tilsammen proteinets fysiske og kemiske egenskaber. Rækkefølgen af aminosyrer i proteinet betegnes den primære struktur. Den bestemmes af nukleotidsekvensen i det DNA, som koder for proteinet.
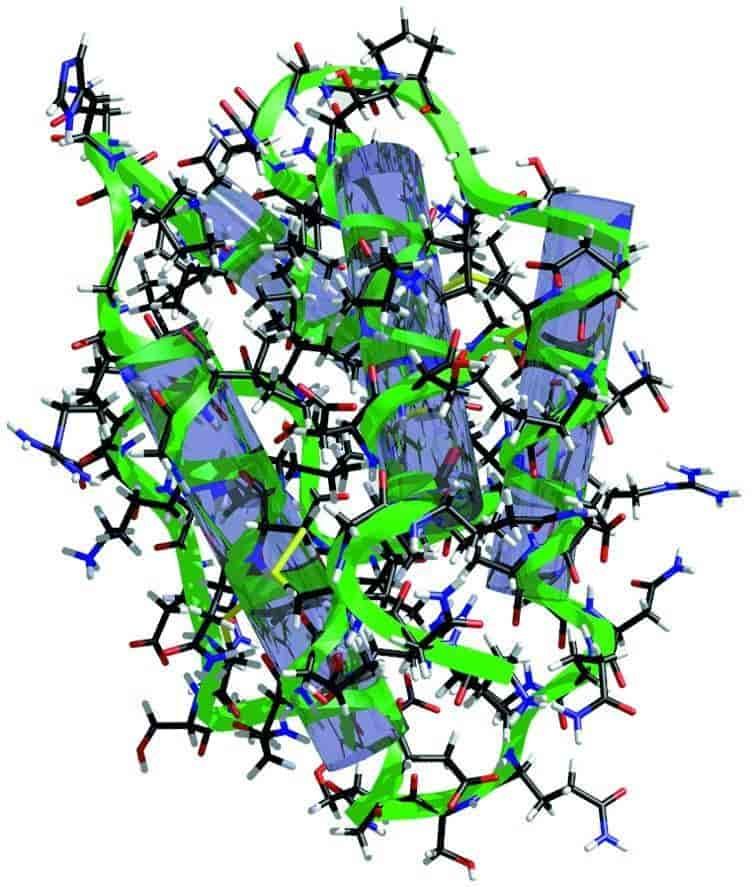
Ved hydrogenbindinger mellem naboliggende aminosyrer foldes kæden til en stabil rumlig struktur, kaldet den sekundære struktur. Det drejer sig om spiralsnoede områder (α-helix), om båndformede strukturer (eng. β-sheets) og om slyngninger af kæden (eng. β-bends). Normalt optræder disse strukturformer på forskellige steder i samme proteinkæde. Proteinernes sekundære struktur blev først beskrevet af den amerikanske kemiker L. Pauling, som også beskrev peptidbindingens kemiske struktur omkring 1950.
De sekundære strukturområder kan yderligere foldes i større rumlige strukturer, som giver proteinets tertiære struktur. Lokalt kan proteinet være foldet i særlige domæner, som har direkte relation til proteinets funktion. Vandmolekyler indgår som et centralt element i proteinets struktur, idet de danner hydrogenbindinger med visse aminosyrer, mens andre aminosyrer har en mere vandskyende (hydrofob) karakter. Hos visse proteiner indgår, foruden hydrogenbindinger, covalente bindinger i den tertiære struktur gennem disulfidbindinger mellem cysteinenheder i polypeptidkæden. Den rumlige opbygning er normalt ansvarlig for proteinernes funktion, idet der i den tertiære struktur optræder lommer, som fx med stor specificitet kan binde de substratmolekyler, hvis omdannelse katalyseres af enzymerne.
Foldningen af peptidkæder til den rigtige rumlige struktur kan foregå spontant, men i forbindelse med den cellulære proteinsyntese medvirker en række proteiner, som sikrer, at der dannes de nødvendige covalente bindinger, og at foldningen foregår specifikt og med hensigtsmæssig hastighed. Proteiner med sådanne funktioner kaldes molekylære chaperoner eller chaperoniner. De medvirker også til, at proteiner, der skal indsættes i membraner eller transporteres ud af cellen, holdes i den rigtige rumlige struktur.
Flere proteinmolekyler af samme art eller forskellige proteinmolekyler danner yderligere en kvaternær struktur, som i cellerne normalt er proteinernes funktionelle form.
På basis af proteinernes kvaternære struktur er der to hovedgrupper, fiberproteiner og globulære proteiner. Fiberproteiner består af ofte endog meget lange kæder af proteinenheder, der fx danner de intracellulære strukturer i cytoskelettet, tubulin (se celle), danner kontraktile elementer såsom myosin i muskelceller, eller uden for cellerne danner fx kollagen i bindevæv og keratin i hår, hud og negle. De sfæriske globulære proteiner findes i cellernes og organismens vandfaser eller bundet i membraner. De fleste globulære proteiner har evne til at binde forskellige kemiske forbindelser som fx hormonreceptorer i cellemembraner, hæmoglobin, som binder ilt i de røde blodlegemer, enzymer samt serum-albumin, som binder en række hydrofobe forbindelser, fx fedtsyrer og lægemidler.
Ødelægges den sekundære, tertiære eller kvaternære struktur af et protein, siges proteinet at denaturere. Denaturering kan skyldes opvarmning, ekstreme pH-værdier, organiske opløsningsmidler eller detergenter og er ofte en irreversibel proces.






Kommentarer
Kommentarer til artiklen bliver synlige for alle. Undlad at skrive følsomme oplysninger, for eksempel sundhedsoplysninger. Fagansvarlig eller redaktør svarer, når de kan.
Du skal være logget ind for at kommentere.