Hæmoglobin, jernholdigt transportprotein, der findes i de røde blodlegemer hos hvirveldyr og giver blodet dets røde farve. Hæmoglobins hovedfunktion er transport af ilt fra respirationsorganerne til organismens væv, hvor ilten forbruges i cellernes stofskifte. Hæmoglobin kaldes oxyhæmoglobin, når det har optaget ilt, mens hæmoglobin uden ilt kaldes desoxyhæmoglobin.
Faktaboks
- Etymologi
- Ordet hæmoglobin kommer af hæmo- og latin globus 'kugle' og -in.
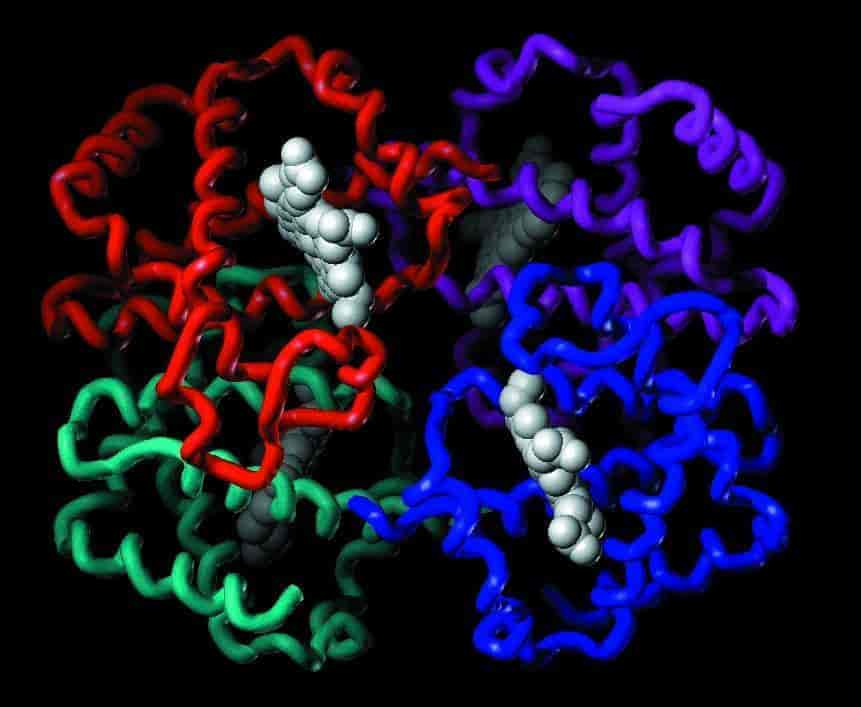
Højerestående hvirveldyrs hæmoglobin er opbygget af to par nærtbeslægtede, ca. 145 aminosyreenheder lange polypeptidkæder kaldet globiner. Til hver kæde er knyttet et hæmmolekyle, der er et kompleks mellem en porfyrinring og en divalent jernion (Fe2+). Hæm er ansvarlig for hæmoglobins iltbindingsevne. Menneskets og andre primaters ene par globinkæder er to ens α-kæder, mens det andet par er to ens β-, γ-, δ- eller ε-kæder. I fosterstadiet dominerer først embryonalt hæmoglobin (α2ε2-globin) og senere hæmoglobin F (α2γ2). Hovedparten af hæmoglobin F erstattes af hæmoglobin A (α2β2) i månederne efter fødslen, og voksne har over 95 % hæmoglobin A og ca. 2 % hæmoglobin A2 (α2δ2). De forskellige globinkæder i hæmoglobin dannes ud fra hver deres gener (globingener). En særlig form er hæmoglobin A1c, som er hæmoglobin A med glukose bundet til dets globinkæder. Koncentrationen af hæmoglobin A1c (ca. 5 % af total hæmoglobin) afspejler blodets middelkoncentration af glukose over flere uger, hvilket udnyttes ved kontrol af sukkersyge (diabetes mellitus).
Hæmoglobin udgør 95 % af de røde blodlegemers tørstofindhold, og koncentrationen i de røde blodlegemers væskefase (cytosol) er ca. 340 g/l. Syntesen af både hæm og globinkæderne i hæmoglobin sker i forstadier til de røde blodlegemer (erythroblaster, reticulocytter). Nedbrydning af hæmoglobin finder sted i særlige celler (makrofager) i knoglemarv, lever og milt. Efter frigørelse af jern og globin fra hæm omdannes hæm til bilirubin, som herefter udskilles med galden til tarmen.
De fire globinkæder i hæmoglobin kan hver binde et iltmolekyle (O2) og fungerer som en funktionel enhed. Det medfører, at bindingen af det første iltmolekyle til en given hæmgruppe forstærker bindingen af ilt til den næste hæmgruppe og så fremdeles. Resultatet er en sigmoid iltbindingskurve, der afspejler, at en lille ændring i ilttryk giver en stor ændring i hæmoglobinets iltmætningsgrad. Fosterets hæmoglobin har større iltbindingsevne end voksnes hæmoglobin, hvilket medfører en effektiv overførsel af ilt fra moder til foster. En række faktorer i de røde blodlegemer såsom koncentrationen af brintioner (pH) og 2,3-difosfoglycerat regulerer hæmoglobins iltbindingsevne. Et fald i pH fremkaldt af optagelse af vævscellernes stofskifteprodukt kuldioxid (CO2) fremmer hæmoglobins iltafgivelse til vævene, et fænomen kaldet Bohr-effekten (se Chr. Bohr).
Ud over ilttransport er hæmoglobin ansvarlig for transport til lungerne af ca. 25 % af det kuldioxid, der frigøres under vævscellernes stofskifte. Hæmoglobin bidrager væsentligt til blodets bufferkapacitet, som har betydning for opretholdelse af konstant pH i blodet på ca. 7,4.
Medfødte defekter i hæmoglobin er langt den hyppigste årsag til arvelig sygdom hos mennesket og resulterer i blodmangel (seglcelleanæmi, talassæmi).




Kommentarer
Kommentarer til artiklen bliver synlige for alle. Undlad at skrive følsomme oplysninger, for eksempel sundhedsoplysninger. Fagansvarlig eller redaktør svarer, når de kan.
Du skal være logget ind for at kommentere.